成脂诱导分化培养基
产品简介:
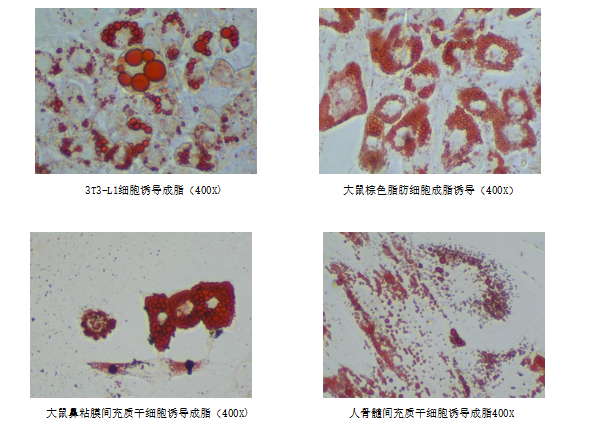
本产品专门为干细胞成脂诱导分化而开发,针对不同类型的间充质干细胞的特性优化分化试剂的配方。本产品经过实验测试,可以用于不同类型间充质干细胞,前体脂肪细胞以及3T3-L1(小鼠胚胎成纤维细胞) 的成脂诱导。
本产品含血清成分,仅用于科研用途,不可用于诊断、治疗、临床及其他用途。
产品规格组成:
名称 | 货号 | 规格 |
成脂诱导分化培养基 | AW-MY002a | 200mL(100+100) |
成脂诱导分化培养基 | AW-MY002b | 400 mL(200+200) |
成脂诱导分化培养基A液:
成分 | 体积(100ml/200ml) | 有效期 |
基础培养基A | 89ml/178ml | 2-8℃ ,6个月 |
FBS | 10ml/20ml | -20℃,5年 |
A液-1 | 100ul/200ul | -20℃,1年 |
A液-2 | 100ul/200ul | -20℃,1年 |
A液-3 | 1ml/ 2ml | -20℃,1年 |
成脂诱导维持培养基B液:
成分 | 体积(100ml/200ml) | 有效期 |
基础培养基B | 90ml/ 180ml | 2-8℃ ,6个月 |
FBS | 10ml/20ml | -20℃,5年 |
B液-1 | 100ul/200ul | -20℃,1年 |
油红O染色液 | 5ml/10ml | 2-8℃ ,6个月 |
产品使用方法:
一、成脂诱导分化培养基配制
1、本产品为试剂盒型,使用前需将试剂盒内各成分试剂混匀。(请勿将A液与B液混淆)
2、使用前,请将血清(FBS)置于4℃化冻,直至血清完全溶解;待血清完全溶解后,将所有添加物于室温溶解。待试剂完全溶解后,将试剂加入到对应培养基中
注:(1)为了保证微量试剂的使用效果,添加试剂前请将试剂管进行短暂离心,使试剂能全部收集至管底。
(2)无菌吸取试剂管中的试剂成分,将枪头伸至培养基液面下方注入,轻微吹打洗涤枪头。再吸取少量培养基洗涤试剂管,尽可能将所有组分完整地加到基础培养基中,保证培养基的效果。
(3)试剂配制应全程在无菌操作台进行。
二、成脂诱导分化细胞准备(以大鼠骨髓间充质干细胞,六孔板培养为例)
1、间充质干细胞的融合度达到 80~90%时,用0.25%胰酶进行消化,注意干细胞生长密度不宜过大,易成片脱落。
2.将消化下来间充质干细胞进行计数,根据计数结果,按 2~3×104 cells/cm2 的细胞密度接种在六孔板中,每孔加入 2 mL 的间充质干细胞完全培养基,置于37℃,5% CO2 的培养箱中进行培养。
4. 当细胞融合度达到 100%时(细胞过饱和有利于激发干细胞的成脂潜能),小心的将孔内完全培养基吸走,向六孔板中加入 2 mL 成脂诱导分化培养基A液(为防止细胞诱导过程出现漂浮现象,可以考虑铺板前先用明胶处理六孔板)。
5. 诱导3天后,吸走六孔板的诱导完全培养基,每孔加入 2 mL 成脂诱导分化培养基B液。
6. 成脂诱导分化培养基B液诱导一天后,吸走B液,更换为成脂诱导分化培养基A液,继续进行诱导3天。
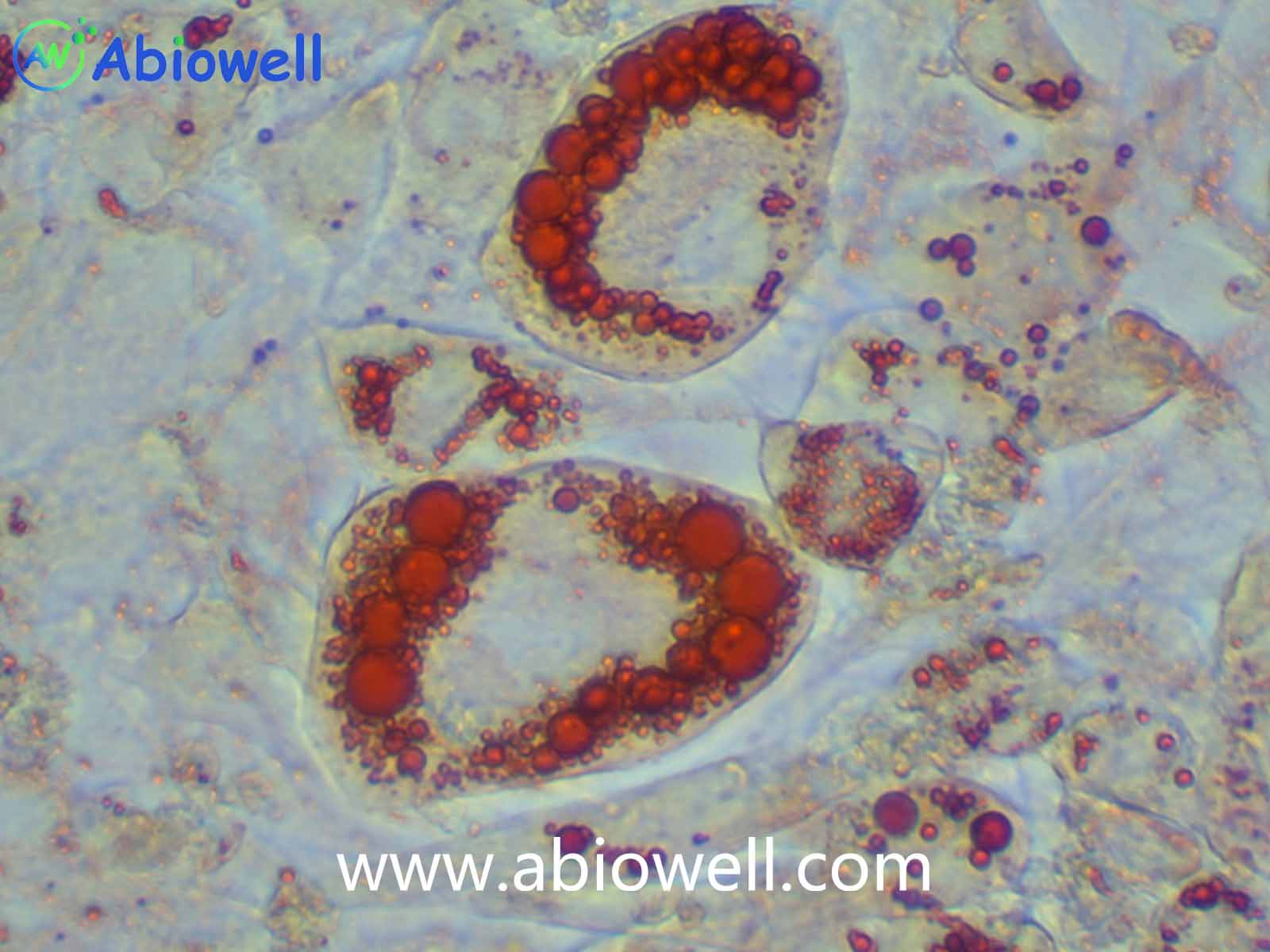
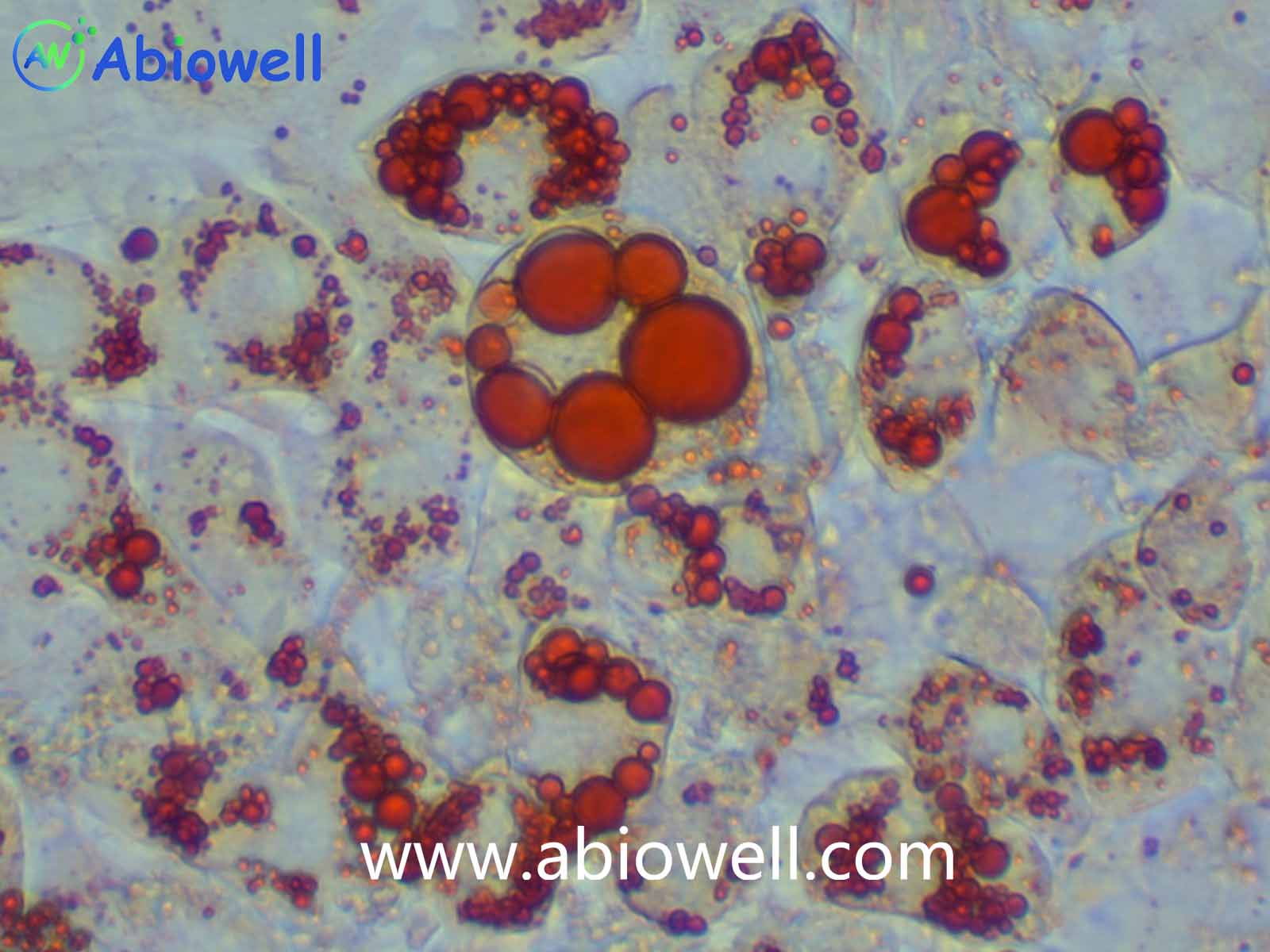
7. A、B 两种培养基交替诱导3~5 次后,当观察到干细胞内出现明显的、足够多的脂滴后,即可结束诱导,根据实验需求对细胞进行染色和后续鉴定。
三、油红O染色
1. 成脂诱导实验结束后,可进行油红O染色确定诱导效果。
2. 吸走孔板里的成脂诱导分化完全培养基,用 1×PBS 润洗 1~2 遍。
3. 加入4%多聚甲醛溶液(覆盖细胞表面即可),对细胞固定 30 分钟。
4. 细胞固定期间,可配制油红O 工作液(饱和油红 O 溶液:蒸馏水=3:2,混匀后用中性滤纸过滤或1500rpm离心去掉残渣)。
5. 吸走4%多聚甲醛溶液,用 1×PBS 润洗 1~2 遍。
6. 以六孔板为例,每孔加入 1mL 油红 O 工作液,室温染色 30 分钟。
7. 吸走油红 O 工作液,用清水润洗至背景杂质洗干净,即可在显微镜下观察诱导和染色效果。(为保证实验效果,建议油红O不要重复使用)
注意:
1.为保证产品的有效性,请不要反复冻融。
2.配制好的诱导培养基保存于2-8℃,有效期为1个月,请根据实验用量合理配制。