广谱彩虹预染蛋白Marker(10-180kD)
产品介绍:
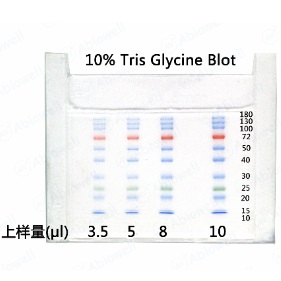
本产品包内含11条预先染色的蛋白质条带,蛋白组分涵盖10kDa至180kDa。本产品经电泳(Tris-Glycine缓冲液)分离后,11条参考条带分别于蓝色、绿色或红色颜色基团共价键连接。为方便目测辨别分子量大小,绿色蛋白条带代表分子量25kDa;红色蛋白条带代表分子量72kDa。蛋白质常规分子量标记应用于辨别蛋白质电泳凝胶(SDS-PAGE)上的蛋白质大小及估算Western blot的转膜效率。
本产品为即用型试剂,可直接使用,无需加热、稀释或添加还原剂。
保存条件:
4℃≤3个月,-20℃≤24个月
使用方法:
1、 加样前在室温数分钟解冻后轻轻摇匀,以确保溶液混合均匀;
2、 取本产品5μl与实验样品同时进行聚丙烯酰胺凝胶电泳;建议有条件的实验室在初次使用本产品时可以根据自身的实验条件和实验习惯通过预实验确定合适的上样量,这样可以节约成本,同时获得效果更佳的实验图片。
注意事项:
1、 在低浓度胶中,低分子量蛋白会泳于染料前缘。
2、 大分子量蛋白转印时建议延长转膜时间或加高转膜电压,如果效果不好建议微调转膜液配方,减少甲醇用量,添加少量SDS(终浓度不超过0.1%)。
3、 预染蛋白质在不同的缓冲体系下有不同的表观分子量,如果在该缓冲体系中事先用非预染蛋白质标定,可以大致确定蛋白质分子量。
4、 为了您的安全和健康,请穿好实验服并佩戴一次性手套和口罩操作。
5、 本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
实验结果:
Figure 1
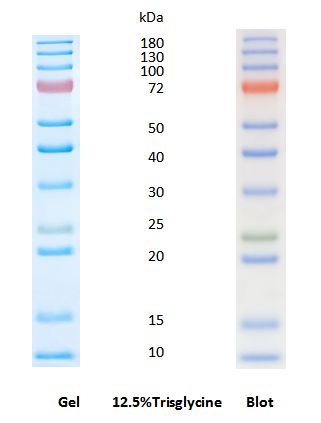
Figure 2
Marker常见案例及分析
1. 蛋白Marker在凝胶上缺失部分条带?
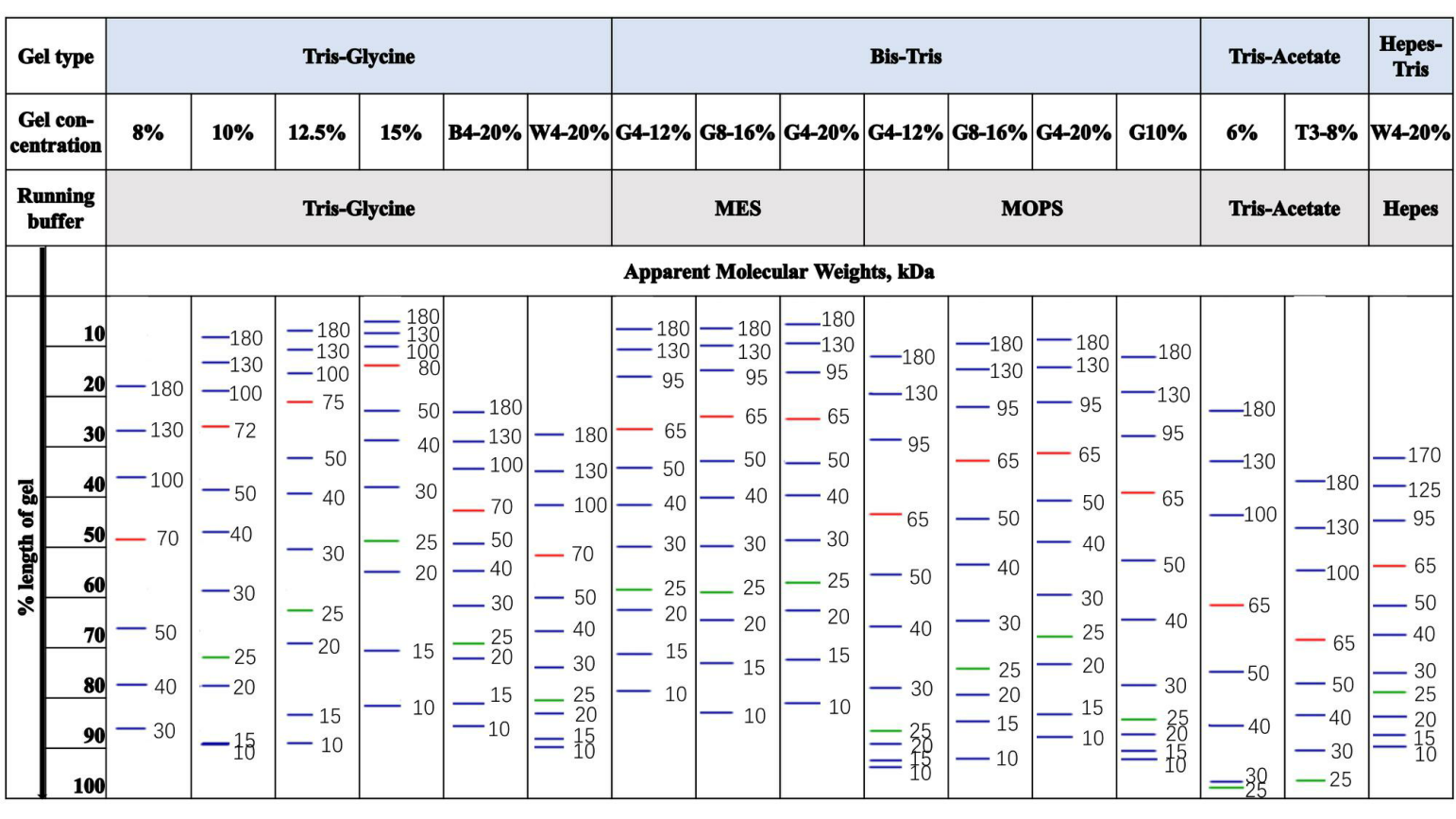
检查使用的凝胶类型和百分比。根据蛋白分子量大小不同,使用不同孔径的聚丙烯酰胺凝胶。常用聚丙烯酰胺凝胶组分中双丙烯酰胺和丙烯酰胺的物质的量的比为1:29(或0.8:29.2),有效分离范围如下表。
在Tris-Glycine胶中,通常12.5%的胶可以将10-180kDa的条带有效分开,10%的胶10/15/17kDa的条带会一起压缩在最前沿,8%的胶10/17/25会一起压缩在最前沿。

2. 为什么你们的蛋白Marker跟其他品牌蛋白Marker条带指示大小不一致?换用不同凝胶,条带大小变化也不一样?
SDS-PAGE中非预染蛋白marker受不同缓冲体系的影响小,而预染蛋白质marker由于多肽链上连接的染料基团受不同缓冲体系的影响比较大,因此预染蛋白marker在使用的不同缓冲体系中,需要用非预染蛋白marker进行标定。
各个品牌条带指示大小不一致,可能有几个因素:(1)采用的标定方式和标示方法不一样。
①标定采用的非预染蛋白质marker不一样。分子量相同的蛋白由于氨基酸残基序列组成不同,与SDS的结合有差异,从而显示出不同的表观分子量。
②由于SDS-PAGE测量误差比较大,需要多次和多平行样测定。(2)各个品牌预染蛋白marker标记采用的染料不一样,导致在不同缓冲体系中的表观分子量变化不一样,有时差距极大。比如,某品牌蓝色条带在Tris-Glycine与Bis-Tris胶中比较,其表观分子量变化均超过10%以上,有的条带变化甚至超过20%以上。
经测定,Abiowell预染蛋白质的蓝色和绿色条带表观分子量在不同的缓冲体胶中基本无变化(Tris-Glycine,Bis-Tris,Tris-acetate,Tricine)或变化极小(Hepes-Tris);橙色条带跟进口品牌变化基本一致,在Bis-Tris,Tris-acetate和部分改良TrisGlycine预制胶中表观分子量降低约10%。基本可以代替非预染marker。
3. 在蛋白marker泳道中看到了一些额外的条带。可以提供一些建议吗?
(1)上样时,请注意确保相邻样品泳道没有交叉污染。蛋白质上样过多,可能会飘散到别的泳道,导致产生额外的条带,这个问题在使用银染凝胶时尤为突出。
(2)Marker储存不当或反复冻融会导致蛋白质降解,产生额外条带。Abiowell预染蛋白marker基本没有这种现象。
4. 您们的蛋白marker的推荐上样体积是多少?
0.75mm和1.0mm建议3-5ul,1.5mm建议8-10ul。
5. 我可以将你们的预染蛋白marker用于非变性凝胶电泳吗?
我们不建议将我们的预染蛋白质分子量标准品用于非变性凝胶电泳。因为它们已经变性(在 SDS 样品缓冲液中)和预还原(通过专有方法),预染marker其标示分子量不代表在非变性凝胶电泳中的样品分子量,但是可以作为一个电泳相对标尺。
6. 为什么预染蛋白marker电泳条带有时上面条带宽下面窄,不是一样的宽窄?
请检查缓冲液的pH和更换pH标准品。
7. Abiowell的预染Marker产品稳定性如何?
Abiowell产品非常稳定。通过我们的测试,Abiowell预染Marker25度放置35天几乎无变化;37度放置28天仅130kDa以上大分子稍变弱,不影响使用;50度放置9天仅130kDa以上大分子稍变弱,不影响使用;80度对Abiowell小分子影响小,大分子逐渐变弱。大分子逐渐变弱可能是高温溶解性不可逆变性,导致溶解性降低。
8. 你们的预染蛋白marker是否不稳定,启用后条带逐渐消失降解,最后只剩最前沿的很深的蓝色条带?
Abiowell产品非常稳定。产生这种现象的原因是由于实验操作不当或其他原因,在预染蛋白marker中引入了某种外源物质导致蛋白marker特异降解成小片段。解决方法:a注意实验操作习惯,使用干净的一次性的取样枪头,b多人使用时,蛋白marker启封后立即用干净的离心管和枪头分装。
9. 使用蛋白marker,条带看起来弥散、模糊,怎么办?
(1)配试剂尽可能使用超纯水。
(2)选用合适浓度的凝胶并确认凝胶在正常有效期内。凝胶放置时间过长会影响分离效果,建议使用新配制的凝胶电泳。特别注意甲叉丙烯酰胺开封后多次称取会很快失效。
(3)电压过高或电泳时间过长,产热过多导致电泳缓冲液温度升高。建议参照产品使用说明书。
(4)电泳缓冲液陈旧,pH值不在缓冲范围内。建议使用新鲜的电泳缓冲液,为了获得理想的结果建议在使用前预冷缓冲液。
(5)存储或取用不当,引入外源污染,导致蛋白降解。建议使用干净的枪头和EP管分装marker,用干净的枪头、缓冲液和电泳设备进行实验。
(6)蛋白marker存储太久并存储不当,或很多次取用。 Abiowell产品不存在这个问题。
10. 为什么有时候带型不整齐,呈向上弯曲状(“微笑状”)或向下弯曲状(“皱眉状”)?
(1)“微笑状”条带可能是由于凝胶横向温度不均匀引起的,凝胶边缘附近的间隔条起到了散热器的作用。可调整实验温度,如将电泳设备置于4°C环境中,向外槽加入更多的缓冲液以散热,降低电泳功率,避免过热,过热能够引起条带扭曲,甚至会导致玻璃板碎裂。
(2)“皱眉状”条带可能是由于电的不连续导致的不均匀电场(如玻璃板底部有气泡等)或凝胶厚度不一致引起的。凝胶边缘不完全聚合也能导致“皱眉状”条带。因此,在电泳开始前需要确保凝胶中或凝胶底部没有气泡,并且凝胶已经完全聚合。
(3)如果在凝胶两侧泳道,由于边缘效应、离子强度不均等原因,均会导致带型变宽或弯曲。建议点样时将蛋白marker放在泳道中间或者在边缘点两个泳道marker。
(4)凝胶配制不匀,凝胶内存有气泡,或点样孔中有细碎的残胶。
(5)配胶过程中,分离胶和浓缩胶的界面不平。
(6)电泳槽存在封闭不严的情况,导致电压不稳,出现跑胶条带倾斜。
(7)检查试剂特别是甲叉丙烯酰胺是否失效。
转膜:
1. 预染蛋白Marker电泳后清晰,但是转膜后颜色变淡?
通常情况下,转膜后Abiowell预染marker条带会更鲜亮,如果颜色变淡,可能有几种情况:
(1)转印不完全
操作不当,比如,转膜没有加冰袋,温度过高;胶和滤纸没夹紧。
转膜条件不适合,转膜时间过长可能透膜,转膜时间过短,蛋白可能残留在胶内。
膜没有充分活化,甲醇浓度太高易造成蛋白穿膜,转移到滤纸上;未活化可能也可能导致膜吸附蛋白能力不强。
膜孔径不适合,建议小分子蛋白使用0.22um膜。
(2)转印正常,可能使用了特殊的转膜缓冲液,建议使用通用转膜缓冲液,或品质有保障的商用转膜缓冲液。另外转膜液均不需要加SDS,若实验必须使用,建议SDS浓度不要超过0.02–0.04%。
2. 洗膜的过程中颜色变浅?
可能使用了比较特殊的缓冲液或者洗涤强度过强。建议使用通用缓冲液,或品质有保障的商用缓冲液,适当洗涤。较小孔径的膜可以在封闭和洗涤过程中更好地保留蛋白质。
3. 为什么转膜后NC/PVDF膜上蛋白标品的条带会丢失?
按标准操作流程,2.6-400kD都可正常转膜成功。
4. 蛋白质marker里小分子蛋白质条带穿膜。该如何解决这个问题?
按照标准操作流程,通常都可得到良好结果。如果出现蛋白条带穿膜而过的情况,重点检查以下几个因素:
1)转印条件,建议适当降低电压、电流或缩短转印时间。
2)确保转膜缓冲液的甲醇浓度和时长合适,Abiowell低分子量预染蛋白marker不需要加甲醇。转膜前使用浓度为10–20%的甲醇平衡PVDF膜,时间一般不超过30秒。
3)SDS浓度适当。Abiowell小分子量和大分子marker转膜时均不需要SDS,若实验必须使用,建议SDS浓度不要超过0.02–0.04%。过多的SDS会阻碍蛋白质与膜的结合。
4) 检查膜的质量、孔径和靶标蛋白质的大小。如果您的目标蛋白质小于10kDa,最好使用0.2μm及以下孔径的膜。